Распределение электронов по энергетическим уровням в атоме серы, Строение атома серы и схема электронной оболочки

Следовательно, число электронов равно 8. Химия Общая характеристика оксидов Чтобы образовать ион, содержащий 10 электронов, атому кислорода необходимо принять два электрона. Химия Электронные оболочки.
Принимает значения: 1, 2, 3,…. Однако на сегодняшний день максимальным главным квантовым числом является 7 , так как в таблице Менделеева всего 7 периодов. Например, главное квантовое число атома фосфора P равно трем, так как этот элемент находится в третьем периоде. Орбитальное квантовое число l , или его еще называют побочным квантовым числом, определяет форму атомных орбиталей траекторий движения электрона.
Максимально возможное орбитальное число всегда будет на единицу меньше главного квантового числа. Важно помнить, что количество атомных орбиталей на каждом уровне равно номеру этого уровня. Например, фосфор, находящийся в третьем периоде, имеет на первом энергетическом уровне одну атомную орбиталь s , на втором — две s и p , на третьем — три s, p и d.
То есть атом фосфора имеет три разных по энергии, но одинаковые по форме s-орбитали — на первом, втором и третьем энергетических уровнях. Магнитное квантовое число m l определяет количество атомных орбиталей ячеек. Таким образом делаем вывод, что на третьем n энергетическом уровне у фосфора находится пять m l различных по энергии d-орбиталей l. Спиновое квантовое число m s характеризует собственное движение электрона — спин.
Как мы уже сказали, спиновое квантовое число характеризует движение электрона вокруг ядра атома. То есть атом может двигаться как по часовой, так и против часовой стрелки.
Это очень напоминает спиннер вращающаяся игрушка. Более того, понятия «спиновый» и «спиннер» созвучны, что позволяет без труда вспомнить смысл этого квантового числа. Квантовые числа позволяют нам собрать информацию о строении атома химического элемента, о распределении его электронов, чтобы затем составить «паспорт». Знания о числе энергетических уровней, форме атомных орбиталей и их количестве изложены в « паспорте » атома. Речь идет о распределении электронов по энергетическим уровням.
Такой «паспорт» называется электронной конфигурацией. Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома энергетическим уровням. Принцип Паули гласит: «На любой орбитали может быть не более двух электронов, при этом их спины и заряды противоположны». Заполнение подуровней тоже регулируется определенным образом, согласно правилу Гунда Хунда :.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а второй электрон добавляется только после заполнения всех орбиталей хотя бы одним электроном. Тут все как в общежитии — сначала каждому студенту дают собственную комнату, но если после этого кому-то еще не хватило места, то новый студент подселяется к кому-то со своей комнатой.
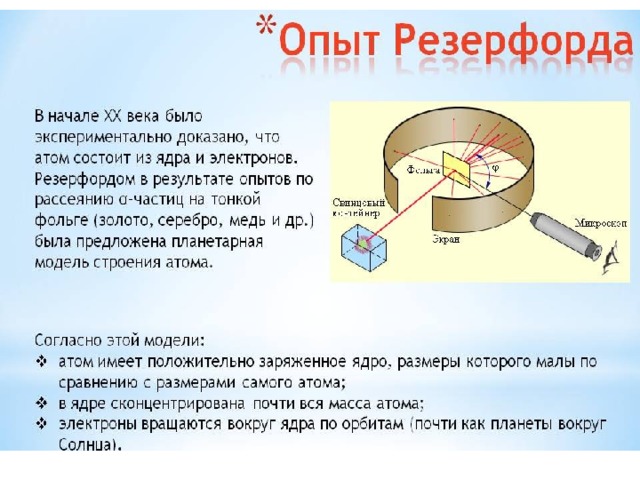
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:. При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как «веселое»: в атоме все спокойно и в порядке. Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие.
Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом «поссориться» и «разъехаться» по разным орбиталям. Тогда атом можно определить как «грустный»: электроны ссорятся, атом грустит. В химии это состояние и называется возбужденным.
Такой «развод» возможен только в пределах одного энергетического уровня.

Теперь мы знаем, что такое «паспорт» атома химического элемента. Однако, как расписать электронную конфигурацию иона?
Ион — это заряженная частица, которая образуется в результате отдачи или присоединения электронов атомами или группой атомов. Анион — отрицательно заряженный ион. Катион — положительно заряженный ион. Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов.
Однако при этом нужно учесть количество электронов, которое отдает или принимает атом, чтобы верно определить конфигурацию внешнего последнего уровня. Чтобы легче было запомнить, рассмотрим следующую аналогию: анион своровал электроны, плохо поступил и стал отрицательным персонажем. Воруют, как правило, у кого-то. В данном случае у катиона. Он явно в этой ситуации является положительным персонажем. Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно.
Полностью заполненный подуровень является очень устойчивым. Такую конфигурацию имеют все благородные газы , и к ней стремятся ионы. Однако не стоит забывать, что и полностью пустой подуровень является устойчивым.
Благородные газы — элементы, расположенные в VIIIA группе, имеющие на внешнем энергетическом уровне предельное число электронов — 8. Я молекула соли с формулой NaCl. Как же образовалась моя молекула? Хлору из VIIА группы не хватало всего одного электрона, чтобы стать более устойчивым иметь на внешнем слое 8 электронов , в то время как у атома натрия из IA группы был лишний электрон, который он был не против отдать, чтобы тоже стать более устойчивым не иметь электронов на внешнем слое.
Передача электрона позволила обоим атомам иметь ту конфигурацию, о которой они мечтали, а также образоваться веществу, которое вы, люди, в обычной жизни зовете поваренной солью».
Благородные газы, они же как настоящие королевские особы, отличаются от всех остальных атомов своей стабильностью. А стабильность им обеспечивает главное богатство всех атомов — предельное число электронов на внешнем уровне — 8 электронов. Благородные газы находятся в отдельной группе VIIIA , как короли живут в замках, расположенных отдельно от обычных домов.
Распределение электронов по энергетическим уровням в атоме азота: 1 2, 5 2. Наибольший радиус атома имеет: 4 сера. КислОТНым оксидом является: 4 оксид фосфора V 6.
Концентрированная серная кислота при комнатной температуре реагирует с обоими веществами: 3 цинком и оксидом меди II Штирлиц Высший разум Ответов у меня нет, но кое-какие знания есть. Остальные ответы.
Free Sweeper Искусственный Интеллект 9 лет назад Рублей за хоть сейчас. Оксана Котова Ученик 9 лет назад Ну пожалуйста срочно нужно, Атомы сера и фосфора имеют: 1 одинаковое число электронов на внешнем слое; 2 одинаковое число электронных слоев; 3 одинаковое число протонов в ядре; 4 одинаковый радиус.
Атомную кристаллическую решетку имеет следующая пара веществ: 1. Алмаз и углекислый газ; 2. Алмаз и белый фосфор; 3. Кварц и алмаз. Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы. После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Исходя из этого, мы можем сказать, что в его атоме:. Проверим себя. В зависимости от положения «последнего электрона» бывают s-, p-, d-, f-элементы :.
Главные подгруппы таблицы Менделеева составляют s- и p-элементы, а между ними расположены переходные элементы. К переходным элементам относятся элементы, которые расположены в побочных подгруппах больших периодов периодической системы Д.
К ним принадлежат d- и f-элементы. Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя. Переходные элементы очень бережливы в вопросе энергии, они любят расставлять все так, как хочется им.
Как они это делают, мы сейчас и узнаем. Одной из главных особенностей переходных элементов является проскок электрона. Для начала поймем, что же это такое? Провал проскок электрона — переход электрона с внешнего энергетического уровня на предвнешний нижележащий. Например, у меди электронная оболочка должна выглядеть как.. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень.
В результате, конфигурация меди выглядит как 3d 10 4s 1. Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9. Определите, какие из указанных элементов в основном состоянии имеют на внешнем электронном уровне один неспаренный электрон.
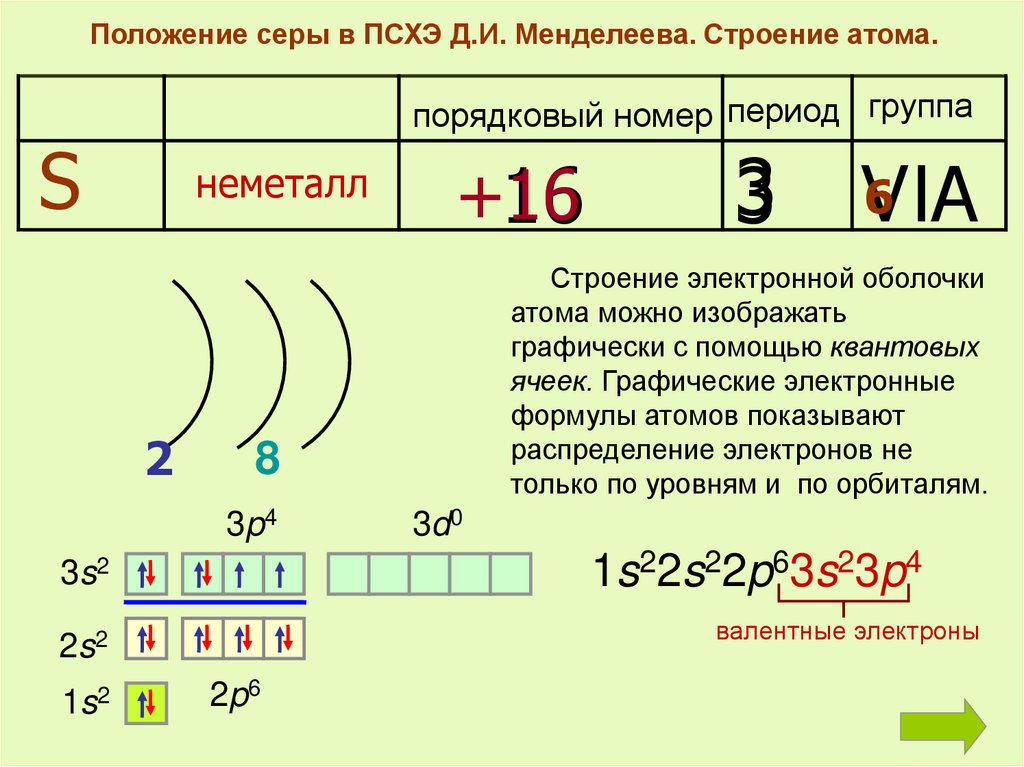
Запишите в поле ответа номера выбранных элементов в порядке возрастания. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон 4s 1 , вариант ответа нам подойдет. Внешним будет 4 уровень, на нем два спаренных электрона 4s 2. Внешним будет 2 уровень, на котором два спаренных электрона 2s 2 и два неспаренных 2p 2.
Благородные газы не имеют неспаренных электронов , их внешний уровень полностью заполнен. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон 4s 1 , вариант ответа нам также подойдет.